بحث عن قوانين الغازات
بحث عن قوانين الغازات
قانون الغاز هو أحد القوانين المتعلقة بالرياضيات الذي يعمل على حساب التأثيرات التي تسببها الغازات الخارجية ومعرفة تأثيرات الضغط ودرجة الحرارة على الغازات. مع زيادة درجة حرارة الغاز ، يمكن أن يؤدي الضغط المستمر إلى زيادة حجمه مع انخفاض درجة الحرارة. يمكن لقوى الضغط أن تقلل من حجم الغاز ، لكن العلاقة دائمًا ما تكون علاقة مباشرة بين حجم الغاز ودرجة حرارته.
وبالتالي ، قد ينص قانون تشارلز التالي على أن كمية معينة من حجم الغاز الموضوعة تحت ضغط ثابت قد تخضع لتغير مباشر متعلق بدرجة الحرارة ، ويتم تمثيل ذلك بالمعادلة V1 / T1 = V2 / t2. الغازات ضعيفة جدًا بطبيعتها ، لكنها شديدة التأثر بالضغط والذرات والجزيئات قريبة جدًا من بعضها.
تشارلز لو
يعمل قانون تشارلز لإيجاد الضغط المستمر للغاز. حيث V1 يعني حجم الغاز عند تعرضه لدرجة الحرارة.
V2 هو حجم الغاز عند تعرضه لدرجة حرارة إضافية.
قانون جاي لوساك
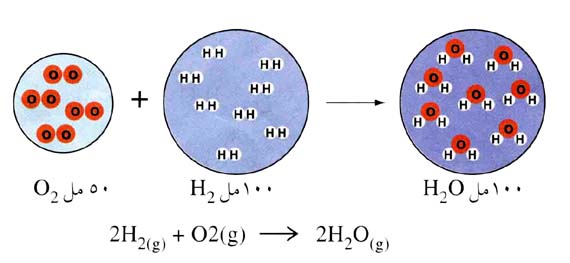
يستخدم هذا القانون لضمان أنه عند تعرض الغاز لدرجة الحرارة ، يبدأ حجمه في التغير ويزداد ضغطه. في حالة الغازات ، قد ينص العالم Lussak على أنه (بالنسبة للكميات الكبيرة من الغاز في حاوية مغلقة ، فإنه يتناسب طرديًا مع درجة الحرارة) ويمكن التعبير عنها بالصيغة (P1 / T1 = P2 / T1) ، هذا حيث P1 هو مقدار ضغط الغاز عند تعرضه لدرجة الحرارة الأولى. بالنسبة للكود P2 ، يمكن أن يكون الضغط الذي يتعرض له الغاز هو درجة الحرارة الثانية.
طريقة الغاز المركب
يعتبر قانون الغاز أحد القوانين المترابطة ، والتي تسمى أحيانًا قانون الغاز المشترك ، P2 / t2) x p1 / t1 = V2 x (V1.
قانون الغاز المثالي
** ممثلة بالرمز (Pv = n × R × T).
** حيث يشير الحرف P إلى الضغط المقاس عند الضغط الجوي.
** V تعني حجم الغاز المقاس باللتر.
** يشير الحرف N إلى مولات الغاز.
** يشير الحرف R إلى الاستقرار العام للغاز ، وهو 0.0821 لتر / مول (كلفن) عند الضغط الجوي.
** يمثل الحرف T درجة حرارة الغاز بالكلفن.
طريقة الأفوكادو
يستخدم هذا القانون لمعرفة الغازات المختلفة. هذا هو الحال عندما يحتوي نفس الحجم على غازات مختلفة ، تخضع لنفس درجة الحرارة والضغط ، وقد تكون المعادلة (V / n = k).
قد يمثل الرمز V حجم الغاز المضغوط.
يمثل الحرف N عدد مولات الغاز.
يشير الحرف K إلى نسبة قبة الغاز.
تُستخدم هذه القوانين في علم الديناميكا الحرارية ، وتجد الحسابات ذات الصلة بالعديد من التطبيقات التي نستخدمها في حياتنا اليومية ، وتُستخدم لحل المعادلات للوصول إلى حجم الغازات وضغطها.
حالة المادة
المواد الموجودة غالبًا هي:
دولة الغاز
المادة موجودة في الحالة الغازية في الدرجة المعتادة من الشكل الغازي. هذا مكان يتكون من جسيمات بسيطة من المادة وبعض الذرات المتباعدة عن بعضها البعض وليس لها شكل محدد أو معروف. .
مثال على ذلك
غاز الأكسجين لعمليات التنفس وغاز النيتروجين المستخدم في منشآت المياه التي تستخدم أيضًا في الغلاف الجوي.
الحالة السائلة
قد تكون المواد الموجودة فيه في صورة سائلة ، وعند تعرضها للحرارة ، قد تنفصل إلى جزيئات مثل الماء.
الحالة الصلبة
في الحالة الصلبة ، قد تتكون المواد من عدة ذرات وجزيئات قريبة من بعضها البعض. على سبيل المثال ، يبدأ الحديد في التليين عند تعرضه لدرجة الحرارة ، ويبدأ في فقدان خصائص قوته ويبدأ في الذوبان. يتم استخدام العديد من المنتجات في مختلف الصناعات من حولنا.