بحث عن نموذج بور الذري
بحث عن نموذج بور الذري
حققت كيمياء الكم اتفاقًا بين النظرية والتجربة ، حتى بالنسبة للجسيمات الكبيرة نسبيًا ، وذلك بفضل قدرتها الحسابية على التغلب على صعوبة معالجة تفاعلات الإلكترون والإلكترون. لفهم البنية الإلكترونية بطريقة مباشرة.
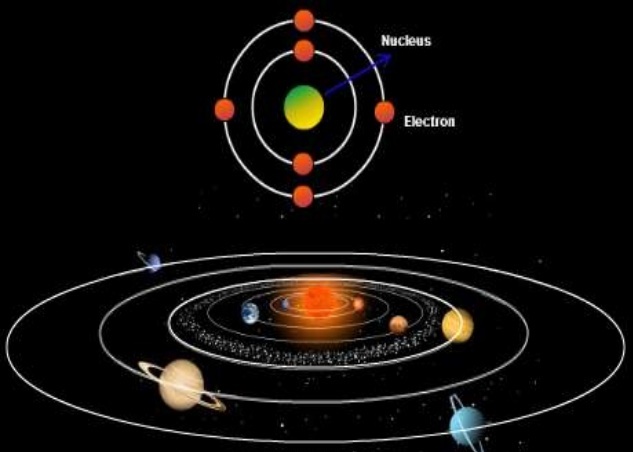
يعد نموذج بوهر للذرة أحد أهم النماذج في الفيزياء الذرية وأحد أبسط النماذج التي يتم تدريسها في ميكانيكا الكم. بوهر وإرنست رذرفورد ، 1913. إنه بسبب تحرك الإلكترونات في مدارات دائرية حول النواة ، على غرار النظام الشمسي ، لكن القوة الجاذبة يتم توفيرها بواسطة القوى الكهربائية بدلاً من الجاذبية.
نموذج بوهر
تاريخ النظرية:
بعد نموذج المكعب لعام 1902 م ، كان نموذج بودنغ البرقوق لعام 1904 م ، ونموذج زحل لعام 1904 ، ونموذج رذرفورد لعام 1910 م ، ونموذج رذرفورد-بور ، أو نموذج بور فقط ، هو الحال في أغلب الأحيان. كان أحد الأسباب الرئيسية لنجاح النموذج هو تفسيره الفيزيائي الكمي ، والذي كان لشرح صيغة Rydberg لخطوط الانبعاث الطيفي للهيدروجين الذري ، والتي كانت معروفة تجريبياً ، ولكن لم يكن لها أساس نظري حتى تقديمها. لنموذج بوهر.
ومع ذلك ، فهو لم يشرح فقط مقدمة معادلة ريدبيرج ، ولكنه قدم تبريرًا للنتائج التجريبية من حيث الثوابت الفيزيائية الأساسية. كنظرية مشتقة لذرات التكافؤ ، كأول تقريب لذرة الهيلوجين باسم ميكانيكا الكم ، يمكن اعتبار هذه النظرية واحدة من النظريات القديمة ، ولكن مع ذلك بسبب بساطتها بالإضافة إلى النظرية وعواقبها الصحيحة ، تم اختياره ليتم تدريسه للطلاب الذين يدرسون ميكانيكا الكم والرسوم البيانية لمستوى الطاقة.
ومع ذلك ، بشكل عام ، يعتقد المجتمع العلمي أن النظرية تفشل عند تطبيقها على عدد صغير من أنظمة الإلكترون ، مثل “جزيء H2” ، ويرتبط النموذج بإجراء لتغيير حجم الأبعاد وتكييفها مع الديناميكا الصبغية. قال ذلك يتعامل هذا النهج مع الإلكترونيات على أنها جسيمات يتم تحديد مواقعها من خلال وظيفة طاقة جبرية محسّنة مشتقة من الشروط كبيرة الأبعاد لمعادلة شرودنغر.
العوامل الرئيسية للنظرية:
تعتمد المدارات المسموح بها على القيمة الكمية المنفصلة للعزم الزاوي المداري L ، أو الاعتماد الزاوي لحجم عنصر الحجم اليعقوبي ، والذي يتنافس مع تنافر الإلكترون والإلكترون الذي يشتمل على الأساسي. يتم تقليل نصف قطر دوران الإلكترون حول البروتون ويتم تدمير الذرة.
أوضح بوهر أن طيف الهيدروجين للإلكترونات يمتص الفوتونات (وحدات كمومية للضوء) وتصدر ، وتغير مستويات الطاقة اعتمادًا على موضع الفوتون.
افتراضات نظرية بوهر:
استخدم بوهر بعض فرضيات رذرفورد حول بنية الذرة. ويرجع ذلك إلى وجود الذرة في مركز النواة الموجبة ، وعدد الإلكترونات السالبة الذي يساوي عدد الشحنات الموجبة التي تحملها النواة ، ودوران الإلكترونات حول النواة ، مما أدى إلى جذب نواة للإلكترونات ، وتتولد قوة مركزية مقابلة ، بإضافة بعض الافتراضات:
1- تتحرك الإلكترونات بسرعة كبيرة حول النواة دون أن تفقد طاقتها.
2- تدور الإلكترونات حول النواة بعدد من المستويات الثابتة ، والمسافات بين المستويات هي مناطق يمنع فيها دوران الإلكترون تمامًا.
3- للإلكترون طاقة محددة ، والتي تعتمد على مسافة مستويات الطاقة النووية وتزداد مع زيادة نصف القطر ، كل مستوى هو عدد صحيح يسمى رقم الكم الأساسي.
4- في الحالة المستقرة ، يبقى الإلكترون عند أدنى مستوى للطاقة ، وعندما يكتسب بعض الطاقة بالتسخين أو التفريغ ، تتهيج الذرة ويبدأ الإلكترون في التحرك مؤقتًا إلى مستوى طاقة أعلى. كمية الكم المكتسبة غير مستقرة أيضًا في المستوى الأعلى ، ثم تعود إلى المستوى الأصلي ، وتفقد نفس كمية الطاقة التي اكتسبتها عند الإثارة في شكل انبعاث ضوئي ، مع طول موجي وتردد مميزين.
5- تمتص الذرات كميات متفاوتة من الطاقة ، وفي نفس الوقت العديد من الذرات تبعث كميات أخرى من الطاقة ، مما يفسر خطوط طيف الهيدروجين.
مع الأخذ في الاعتبار الكم ، وهو مقدار الطاقة المكتسبة ، عندما ينتقل الإلكترون من مستوى طاقة إلى آخر ، فإنه يقوم بقفزة محدودة بدلاً من الاستقرار على المسافة بين مستويات الطاقة. انتقل إلى موقع مستوى الطاقة.


